Enige tijd geleden konden een team van wetenschappers verrassende observaties over waterstof waarnemen en opmerkelijke parallellen aantonen tussen waterstof onder extreme druk en de atomaire koolstofvariant en wondermateriaal – grafeen.
In het begrip van de academische wetenschap is waterstof het meest voorkomende materiaal in de kosmos en met slechts één enkel elektron per atoom lijkt het bedrieglijk eenvoudig.
Bijgevolg is waterstof, sinds de geboorte van kwantummechanica een eeuw geleden, de proeftuin voor theorieën van chemische bindingen. Inzicht in de aard van de chemische bindingen in extreme omgevingen is van cruciaal belang voor de uitbreiding van ons begrip van materie over de brede waaier van condities die worden aangetroffen in het universum.
Het observeren van het gedrag van waterstof onder zeer hoge druk is een enorme grote uitdaging voor onderzoekers.
Teams konden constateren dat bij een druk van 2 tot 3,5 miljoen keer de normale atmosferische druk waterstof verandert in een onverwachte structuur dat bestaat uit gelaagde platen, anders dan een dicht samengepakt metaal zoals vele jaren eerder was voorspeld.
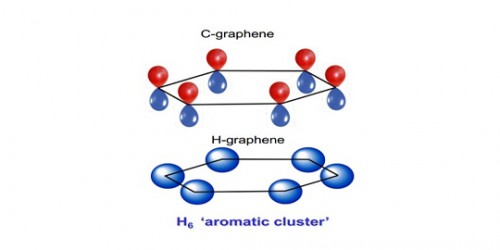
Deze waterstof platen lijken op de koolstofverbinding van de koolstofvariant, grafeen.
Lagen van grafeen zijn vervaardigd uit een honingraatstructuur van zes-atoom koolstofringen.
Ongeveer een decennium geleden werd grafeen voor het eerst gesynthetiseerd. Het materiaal is zeer licht, terwijl ongelooflijk sterk, en vervoert zeer efficiënt warmte en elektriciteit.
Deze eigenschappen beloven revolutionaire technologie, met inbegrip van geavanceerde optische elektronica voor schermen, fotovoltaïsche cellen, betere batterijen en andere energie-opslag apparaten.
Uit het werk van Naumov en Hemley blijkt dat de stabiliteit van de ongebruikelijke waterstofstructuur voortvloeit uit de intrinsieke stabiliteit van de waterstofringen. Deze ringen vormen vanwege de zogenaamde aromaticiteit, wat goed begrepen is in koolstofhoudende moleculen zoals benzeen, en in grafeen.
Aromatische structuren nemen de vorm aan van een ring die kan gezien worden als afwisselende enkele en dubbele koolstofbindingen. Maar wat er werkelijk gebeurt, is dat de elektronen die deel uitmaken van deze theoretische wisselende bindingen worden gedelokaliseerd en zweven in een gedeelde cirkel rond de binnenkant van de ring, en zo de stabiliteit verhogen.
De studie van Naumov en Hemley ontrafelde dat waterstof in eerste instantie een donker slecht geleidend metaal wordt zoals grafiet in plaats van een conventioneel glanzend metaal en een goede geleider, zoals oorspronkelijk was voorgesteld in theoretische berekeningen die teruggaan tot de jaren 1930, aan het begin van kwantummechanische modellen voor vaste stoffen.
Hoewel de ontdekking van deze karakteristieke gelaagde plaat van dichte waterstof als een verassing komt voor velen, voorspelden chemici – dertig jaar voor de ontdekking van grafeen- de structuur op basis van eenvoudige chemische overwegingen.
Hun werk wordt gevalideerd en uitgebreid met de nieuwe bevindingen.
“Alles samen, onze resultaten suggereren dat chemische bindingen plaatsvinden over een veel breder scala van omstandigheden dan men eerder had overwogen. De structurele effecten van deze chemische bindingen onder extreme omstandigheden kunnen zeer verschillend zijn dan die waargenomen onder de normale omstandigheden en ons bekend zijn.” zei Hemley.
Via dit onderzoek konden wetenschappers de intense relatie aantonen tussen waterstof en koolstof. Vermoedelijk één van de meest openbarende onderzoeken ooit gepubliceerd op de website, hoewel het op dit moment misschien nog vrij onzeker lijkt waarom.
Misschien brengt de wetenschap ons op een dag wel het nieuws dat waterstof wel degelijk koolstof is, als een energieveld of drukconditie waarvan de spanning werd gehalveerd. Te vergelijken met de relatie van een snaar en de onderliggende snaar op een gitaar, dat een octaaf lager komt te liggen als een tonale noot in de harmonieuze melodie van het universum.
Waterstof werd er echter nooit van verdacht koolstof te zijn en staat momenteel alleen en eenzaam op de eerste rij in de periodieke tabel van chemische elementen in hoe die werd omschreven door Mendeljeev, zonder voorganger als inert gas terwijl alle eenheden in paren worden geproduceerd.
De reden waarom elke opeenvolgende tonale noot – die de elementen van materie vormen – één octaaf hoger komt te liggen bestaat geheel uit verhoogde druk. Zoals hier met het principe waarin H wordt geplet tot C.
Wat men beter kan begrijpen als men dit voorstelt als lucht dat wordt gecomprimeerd in een afgesloten doos waarin men een fluitje plaatst.
Te meer lucht in de doos wordt gelaten, te hoger het fluitje klinkt wanneer men de klep opent. De trillingen worden sneller.
Hetzelfde staat te gebeuren wanneer men de snaar aandraait. Eenzelfde snaar kan vele verschillende tonen (kleuren – lichten) opleveren wanneer de snaar wordt gestemd door de pennen hoger of lager aan te spannen.
Terwijl we in het achterhoofd houden dat koolstof uit een toon bestaat dat als enige element alle mogelijke golflengtes kan beluisteren en uitzenden.
De academische wetenschap stond er ook nog nooit bij stil dat koolstof misschien geen element is, maar eerder een compleet systeem, met alle andere elementen erin.
Bron: Phys.org
Foto: Carneige’s Ivan Naumov en Russell Hemley